LA DISTRIBUCIÓN ELECTRONICA
están ordenados en un átomo. Como los electrones son fermiones están sujetos al principio de exclusión de Pauli, que dice que dos fermiones no pueden estar en el mismo estado cuántico a la vez. Por lo tanto, en el momento en que un estado es ocupado por un electrón, el siguiente electrón debe ocupar un estado mecanocuántico diferente.
En el átomo, los estados estacionarios de la función de onda de un electrón (los estados que son función propia de la ecuación de Schrödinger HΨ = EΨ en donde H es el hamiltoniano) se denominan orbitales, por analogía con la clásica imagen de los electrones orbitando alrededor del núcleo. Estos estados tienen cuatro números cuánticos: n, l, m y s, y, en resumen, el principio de exclusión de Pauli quiere decir que no puede haber dos electrones en un mismo átomo con los cuatro valores de los números cuánticos iguales. Los más importantes de estos son el n y el l.
Tabla de contenidos [ocultar] 1 Valores de los números cuánticos 2 Bloques de la tabla periódica 3 Regla del octeto 4 Distribución electrónica 5 Véase también
Valores de los números cuánticos [editar]El primer número cuántico ¨n¨(llamado a veces número cuántico principal) corresponde a los diferentes nivelesde energía permitidos o niveles cuánticos; los valores que toma son 1, 2, 3, 4,…Para n=1 se tiene el nivel de menor energía. En algunos casos (por ejemplo en espectroscopia de rayos X) también se denotan como K, L, M, N,… El segundo númerocuántico l corresponde al momento angular del estado. Estos estados tienen la formade armónicos esféricos, y por lo tanto se describen usando polinomios de Legendre.A estos subniveles, por razones históricas, se les asigna una letra, y hacen referencia al tipo de orbital (s, p, d, f).Los valores que puede tomar l son: 0, 1,2,…, (n-1), siendo n el número cuántico principal. El tercer número cuántico, m, puede tomar los valores desde -l a l, y por lo tanto hay un total de 2l+1 estados posibles. Cada uno de estos puede ser ocupado por dos electrones con espines opuestos, lo que viene dado por el número cuánticos (spin), que puede valer +1/2 o −1/2. Esto da un total de 2(2l+1) electrones en total (tal como se puede ver en la tabla anterior). En resumen, estos son los valores que pueden tomar los números cuánticos cuando entran en función:
Valor de l Letra Máximo número de electrones 0 s 2 1 p 6 2 d 10 3 f 14
Número cuántico Valores posibles n 1, 2, 3,… l 0,…, (n-1) m -l,…, 0,…,+l (2l+1) s −1/2, +1/2
Bloques de la tabla periódica [editar]Las propiedades químicas de un átomodependen mucho de cómo están ordenados los electrones en los orbitales de másenergía (a veces llamados de valencia), aparte de otros factores como el radioatómico, la masa atómica, o la accesibilidad de otros estados electrónicos.
Conforme se baja en un grupo de elementos, desde el más ligero al más pesado, los electrones más externos, en niveles del carbono y el plomo tienen cuatro electrones en sus orbitales más externos. Debido a la importancia de los niveles energéticos más exteriores, las distintas regiones de la tabla periódica se dividen en bloques, llamándolas según el último nivel ocupado: bloque s, bloque p, bloque d y bloque f, tal como se ve en el diagrama.
Regla del octeto [editar]Para que un átomo sea estable debe tener todos sus orbitales llenos (cada orbital con dos electrones, uno de spin +1/2 y otro de spin −1/2) Por ejemplo, el oxígeno, que tiene configuración electrónica 1s², 2s², 2p4, debe llegar a la configuración 1s², 2s², 2p6 con la cual los niveles 1 y 2 estarían llenos. Recordemos que la Regla del octeto, justamente establece queel nivel electrónico se completa con 8 electrones, excepto el Hidrógeno, que se completa con 2 electrones. Entonces el oxígeno tendrá la tendencia a ganar los 2 electrones que le faltan, por esto se combina con 2 átomos de hidrógenos(en el caso del agua, por ejemplo), que cada uno necesita 1 electrón (el cual recibe del oxígeno) y otorga a dicho átomo 1 electrón cada uno.De este modo, cada hidrógeno completó el nivel 1 y el oxígeno completó el nivel 2.
En química se denomina orbital a la zona del espacio que rodea a un núcleo atómico donde la
probabilidad de encontrar un electrón es máxima, cercana al 90%.
probabilidad de encontrar un electrón es máxima, cercana al 90%.
Distribución electrónica [editar]Es la distribución de los electrones en los subniveles y orbitales de un átomo. La configuración electrónica de los elementos se rige según el diagrama de Moeller:
1s/ 2s 2p/ 3s 3p/ 4s 3d 4p/ 5s 4d 5p/ 6s 4f 5d 6p/ 7s 5f 6d 7p
Ahora ya podemos utilizar el orden de energías de los orbitales para describir la estructura electrónica de los átomos de los elementos. Un subnivel s puede acomodarse 1 o 2 electrones. El subnivel p, puede acomodarse 1 a 6 electrones; el subnivel d de 1 a 10 electrones y el subnivel f de 1 a 14 electrones. Ahora es posible describir la estructura electrónica de los átomos estableciendo el subnivel o distribución orbital de los electrones. Los electrones se colocan, primero, en los subniveles de menor energía, y cuando estos están completamente ocupados, se usa el siguiente subnivel de energía más alto. El único electrón del átomo de hidrogeno se localiza en el subnivel S del primer nivel de energía. Un método abreviado para indicar la configuración electrónica es:
A esto se le llama notación de orbitales o subniveles e indica que hay electrón en el subnivel s del primer nivel de energía. El núcleo de electrones en el subnivel se indica con el superíndice a la derecha del subnivel. Los 2 electrones del helio se encuentran en la posición de energía más baja, esto es, el subnivel s del primer nivel de energía.
Para determinar la configuración electrónica de un elemento, solo hay que decidir cuantos electrones hay que acomodar y entonces distribuirlos en los subniveles empezando con los de menor energía e ir llenando hasta que todos los electrones estén distribuidos. Un elemento con número atómico más grande tiene un electrón más que el elemento que lo precede. El subnivel de energía aumenta de esta manera:
Subnivel S, P, D ó F: Aumenta el nivel de energía. Sin embargo, existen exepciones como ocurre en los elementos de transición al ubicarnos en los grupos del cromo y del cobre, en los que se promueve el electrón dando así una configuración fuera de lo común
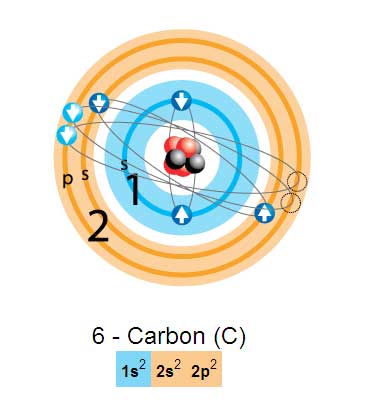


¿Esta es la distribución electrónica del elemento carbono?
ResponderEliminaristi is li distribiciin ilictrinici dil iliminti cirbini?
Eliminarsi, idiota.
Te la rifaste XD
EliminarCuál es??
Eliminarq pedo XD
ResponderEliminar😂😂
ResponderEliminaruna sugerencia las letras estan muypequeñas
ResponderEliminarve al grano, no entendí nada
ResponderEliminarque pvtas we???¿¿¿
ResponderEliminarMamense un webo todos
ResponderEliminaresta es la configuración electrónica no la distribución
ResponderEliminar